سنـة أولـى ثانـوي :: تحضير نصوص الادب العربي , حلول تمارين الكتب المدرسية ’ بنك الفروض والاختبارات , حلول تمارين الرياضيات , حلول تمارين الفيزياء , حلول تمارين اللغة العربية , حلول تمارين الفرنسية , حلول تمارين الانكليزية .
|
|
#1
:: عضوة شرفية ::





تاريخ التسجيل : Oct 2016
الدولة : الجزائر - مستغانم
العمر : (غير محدد)
الجنس : انثى
المشاركات : 4,569
تقييم المستوى : 17
قواعد التوزيع الإلكتروني للعناصر

ماذا يقصد بـ ترتيب الإلكتروني للعناصر
ويحكم توزيع الإلكترونات في مدارات الذرة عدد من القواعد :
قاعدة أوف باو ،
قاعدة هوند ،
قاعدة الاستبعاد لباولي .
أولا : قاعدة أوف باو .او مبدأ البناء التصاعدى
تدخل الإلكترونات في مستويات الطاقة الفرعية ذات الطاقة المخفضة أولا ثم تملأ الأعلى منها بعد ذلك .
ملاحظة : طاقة المدار تزداد بزيادة عدد الكم.
عدد الكم الرئيسي والتي غالبا ما تكتب n
وهو يمثل طاقة المدار ومدى بعده عن النواة.
ويمكن توضيح ترتيب ملء المدارات حسب قاعدة أوف باو من خلال الرسمتين التاليتين
كلاهما صحيحية لكن الإختلاف في التصميم

* حيث
المدار S يستوعب عدد 2 إلكترون
المدار p يستوعب عدد 6 إلكترون
المدار d يستوعب عدد 10 إلكترون
المدار f يستوعب عدد 14 إلكترون
18Ar: 1s2 2s2 2p6 3s2 3p6
36Kr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24d10 5p6
79Au: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s1 4f14 6d10
_____________
ثانيا: مبدأ باولي للاستبعاد
_________________
بعض الامثلة

ماذا يقصد بـ ترتيب الإلكتروني للعناصر
هو الكيفية التي تتوزع فيها الإلكترونات في مدارات الذرة .
ويحكم توزيع الإلكترونات في مدارات الذرة عدد من القواعد :
قاعدة أوف باو ،
قاعدة هوند ،
قاعدة الاستبعاد لباولي .
أولا : قاعدة أوف باو .او مبدأ البناء التصاعدى
تدخل الإلكترونات في مستويات الطاقة الفرعية ذات الطاقة المخفضة أولا ثم تملأ الأعلى منها بعد ذلك .
ملاحظة : طاقة المدار تزداد بزيادة عدد الكم.
عدد الكم الرئيسي والتي غالبا ما تكتب n
وهو يمثل طاقة المدار ومدى بعده عن النواة.
ويمكن توضيح ترتيب ملء المدارات حسب قاعدة أوف باو من خلال الرسمتين التاليتين
كلاهما صحيحية لكن الإختلاف في التصميم
الرسمة توضح طريقة التوزيع الإلكتروني حيث نبدء من 1s ثم 2s ثم 2p ثم 3sوهكذا
* حيث
المدار S يستوعب عدد 2 إلكترون
المدار p يستوعب عدد 6 إلكترون
المدار d يستوعب عدد 10 إلكترون
المدار f يستوعب عدد 14 إلكترون
مثال التوزيع الإلكتروني للـعناصر التالية
18Ar: 1s2 2s2 2p6 3s2 3p6
36Kr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24d10 5p6
79Au: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s1 4f14 6d10
ملاحظة من خلال ماسبق وفقا لقاعدة أوف باو
نلاحظ أنه يتم ملء المدار 4S قبل المدار 3d
والسبب ان تداخلات المدارات تجعل مدار 3d أعلى في الطاقة من مدار 4S .
نلاحظ أنه يتم ملء المدار 4S قبل المدار 3d
والسبب ان تداخلات المدارات تجعل مدار 3d أعلى في الطاقة من مدار 4S .
استثناءات هناك استثناءات لقاعدة أوف باو .
حالات استقرار المدار أن يكون ممتلىء أو نصف ممتلىء أو فارغ
ولهذا نجد بعض الاستثناءات من قاعدة أوف باو ولتوضيح ذلك نأخذ
المثال التالي
ولهذا نجد بعض الاستثناءات من قاعدة أوف باو ولتوضيح ذلك نأخذ
المثال التالي
مثال: النحاس له العدد الذري 29
Cu : 1S2 2S2 2P6 3S2 3p6 4S1 3d10
نلاحظ أنه تم ملأ المدار 3d ومن ثم العودة لمدار 4s .
_____________
ثانيا: مبدأ باولي للاستبعاد
ينص هذا المبدأ على أنه لا يمكن أن تتساوى الأعداد الكمية الأربعة لأي إلكترونين في ذرة واحدة !
فعلى سبيل المثال،
لا يمكن لإلكترونين في ذرة واحدة أن يكون لهم ذات أعداد الكم الأربعة؛
فإذا كان n، وℓ، وmℓ متشابهين بين إلكترونين أو أكثر، فإن ms يجب أن يكون مختلفاً
بمعنى أن كل واحد منهم يدور باتجاه معاكس للآخر، وهكذا.
لا يمكن لإلكترونين في ذرة واحدة أن يكون لهم ذات أعداد الكم الأربعة؛
فإذا كان n، وℓ، وmℓ متشابهين بين إلكترونين أو أكثر، فإن ms يجب أن يكون مختلفاً
بمعنى أن كل واحد منهم يدور باتجاه معاكس للآخر، وهكذا.
_________________
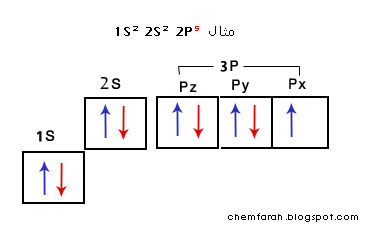
قاعدة هوند
تميل الإلكترونات أن تكون منفردة في المدار الذري مالم يكن عددها أكبر من عدد المدارات .
مثال : مدار P يحوي 3 مدارات متساوية في الطاقة هيPx ,Py, Pz كل منهم يستوعب إلكترونين،
فإذا كانت عدد الإلكترونات 3 أو أقل فأنه يتم توزيعها فرادى على المدارات الثلاث
وإذا زاد عن الثلاثة فيتم البدء في دمج الإكترونات.
فإذا كانت عدد الإلكترونات 3 أو أقل فأنه يتم توزيعها فرادى على المدارات الثلاث
وإذا زاد عن الثلاثة فيتم البدء في دمج الإكترونات.
بعض الامثلة
للوصول إلى التركيب الإلكتروني الصحيح لذرة العنصر يجب مراعاة القواعد الآتية :
1 – عدد الإلكترونات التي يتم وزيعها على المدارات الذرة المتعادلة يساوي العدد الذري للعنصر .
2 – لا يحتوي المدار الواحد أكثر من إلكترونين .
3 – مراعاة قاعدة هوند عند توزيع الإلكترونات على المدارات المستويات الفرعية .
1 – عدد الإلكترونات التي يتم وزيعها على المدارات الذرة المتعادلة يساوي العدد الذري للعنصر .
2 – لا يحتوي المدار الواحد أكثر من إلكترونين .
3 – مراعاة قاعدة هوند عند توزيع الإلكترونات على المدارات المستويات الفرعية .
4 – عند توزيع الإلكترونات على المدارات تملأ المدارات بدء من المدار الأقل طاقة فالمدار الأعلى طاقة .
التعديل الأخير تم بواسطة رحيق الصمت ; 2018-01-20 الساعة 10:47
«
الموضوع السابق
|
الموضوع التالي
»
الذين يشاهدون محتوى الموضوع الآن : 1 ( الأعضاء 0 والزوار 1)
 المواضيع المتشابهه
المواضيع المتشابهه
|
||||
| الموضوع | كاتب الموضوع | المنتدى | مشاركات | آخر مشاركة |
| 🌹دروس خصوصية في مآدة آلفيزيآء✒🌹 | ♡~دُمُوعُ القَلْبِ~♡ | سنـة أولـى ثانـوي | 79 | 2018-04-28 21:54 |
| أهم قواعد اللغة العربية | AmiRa AnG | منتدى التعليم العام | 8 | 2017-07-12 11:08 |
| التوزيع السنوي للسنوات المتوسط في اللغة العربية و الاسلامية | مآجٍدِة لُِرٍبَهـآ سآجٍدِة | سنـة أولى متوسـط | 1 | 2017-04-11 21:50 |
| طلب مساعدة (بحث حول ادارة التوزيع ) | farahe 18 | كلية العلوم التجارية و العلوم الاقتصادية و التسيير | 18 | 2015-11-18 09:26 |
| الوحدة : 03 أثر العلم في حياة الإنسان الموضوع الكتاب الإلكتروني | souzou | تحضير نصوص اللغة العربية للسنة الأولى متوسط - الجيل الثاني | 0 | 2014-09-27 18:13 |
الساعة معتمدة بتوقيت الجزائر . الساعة الآن : 15:00










 العرض الشجري
العرض الشجري